Суперразрешение, или современные методы микроскопии
ГлавнаяСуперразрешение, или современные методы микроскопииСуперразрешение,
или
современные методы микроскопии
Антони ван Левенгук, совершая путешествие во времени, приветствует своих юных друзей! 21 век… Думал, что удивиться уже будет нечему. А оказывается… Каждый день приносит нам столько нового и интересного! Для меня, думаю, и для вас, друзья, станет открытием встреча с флуоресцентным микроскопом, конфокальной и электронной микроскопией…
Прежде чем приступим к знакомству с микроскопами, давайте научимся правильно произносить слова. В них много тайн и загадок. Обратимся к нашему помощнику - Его Величеству СЛОВАРЮ.
Флуоресцентный микроскоп и иммунофлуоресценция
В 1911 году Оскар Хеймштадт разработал первый флуоресцентный микроскоп, в котором мощный источник света возбуждал свечение во флуоресцентных веществах. А флуоресценция, друзья, это излучение света веществом, которое поглотило свет!
В 1929 году его конструкцию значительно улучшили Филипп Эллингер и Август Хирт, которые создали микроскоп, где с помощью светофильтров эффективно отсекался возбуждающий свет, что позволяло рассмотреть даже слабую флуоресценцию. В это время биохимики и генетики уже начинали исследовать отдельные белки и гены, но в микроскопии не было инструмента, который бы позволил точно пометить отдельный белок. Таким инструментом удивительным образом оказались антитела – белки, которые иммунная система использует для выявления и нейтрализации возбудителей.
Джон Маррак одним из первых связал антибактериальное антитело с красителем (R-солью) и окрасил им бактериальный препарат. Изобретение флуоресцентного микроскопа и связывание антител с яркими флуоресцентными красителями позволило получать ярко окрашенные препараты. Меченые антитела помогали окрасить не только возбудителей болезней – иммунизируя животных с помощью различных белков, стало возможным получать антитела для выявления местоположения и количества этих белков внутри клеток и тканей.
.png) | 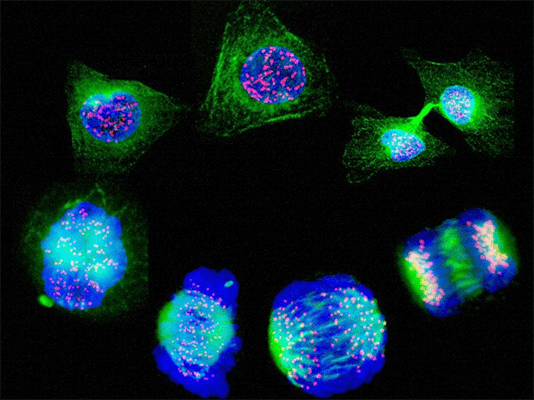 | 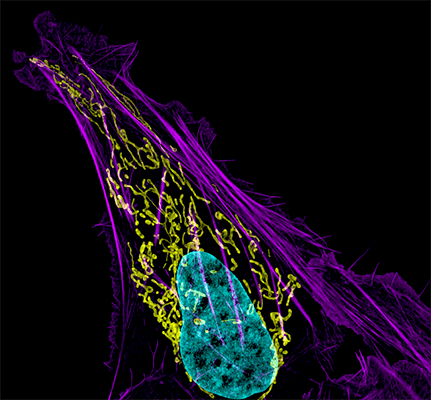 |
| Возможности флуоресцентной микроскопии. Клетки бычьего эндотелия BPAEC (окраска на митохондрии, ДНК и актин) | Возможности флуоресцентной микроскопии. Стадии митоза (синий – ДНК, зеленый – веретено деления, красный – центромеры) | Возможности флуоресцентной микроскопии. Клетки остеосаркомы человека (окраска на митохондрии, ДНК и актин) |
Для того чтобы наблюдать за белками вживую, требовалось найти способ прикрепить к ним светящуюся молекулу – флуорофор. Первым таким флоурофором оказался знаменитый зеленый флуоресцентный белок (GFP). Впервые GFP выделил из медузы Aequorea victoria Осаму Симомура в 1962 году. Затем зеленый флуоресцентный белок с помощью генетической инженерии научились вставлять в клетки и включать в состав белков-химер, где его «сшивали» с изучаемым белком.
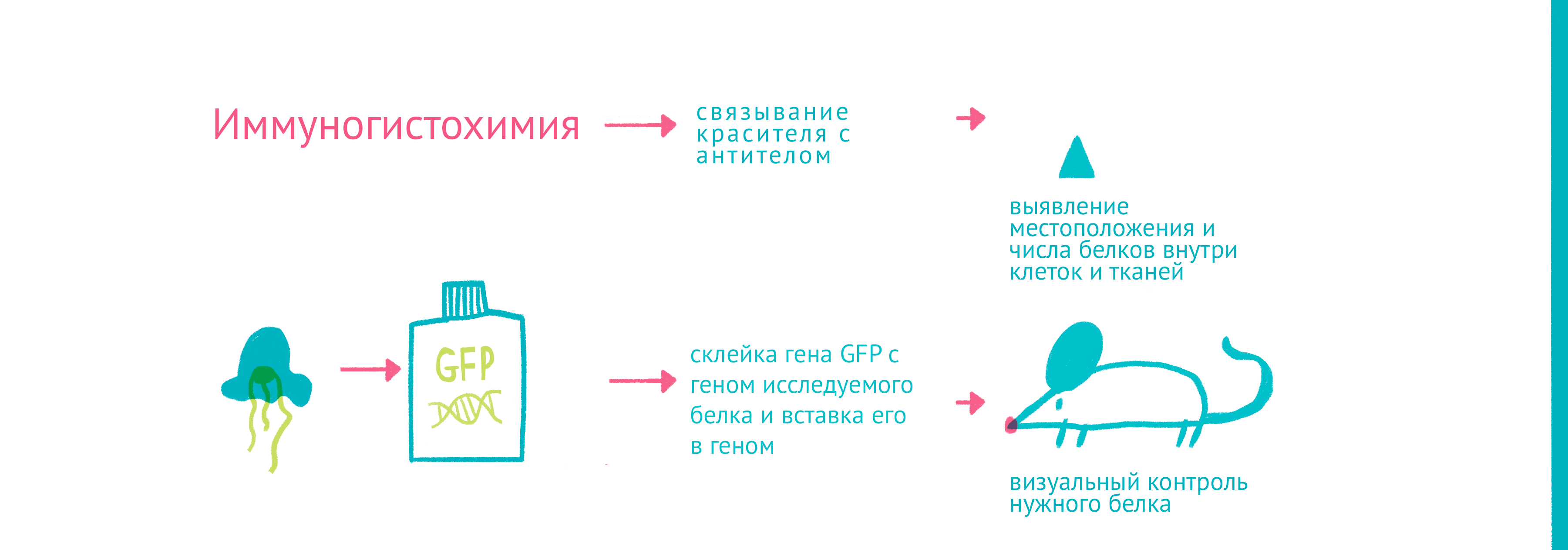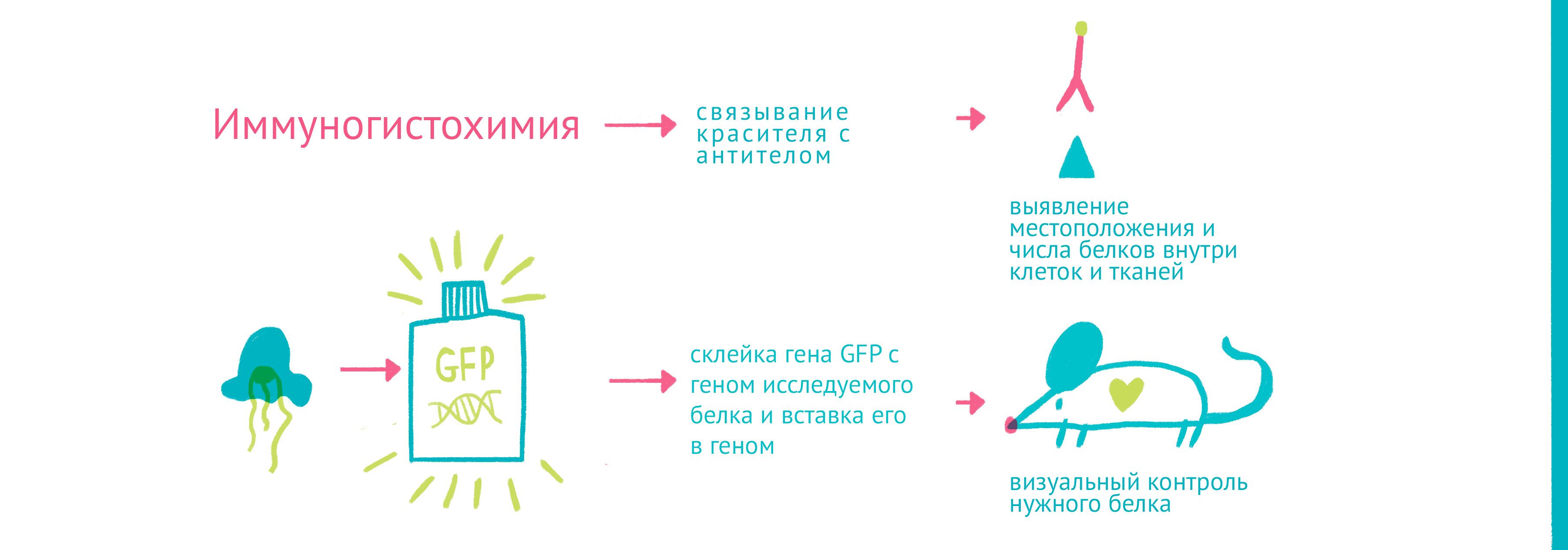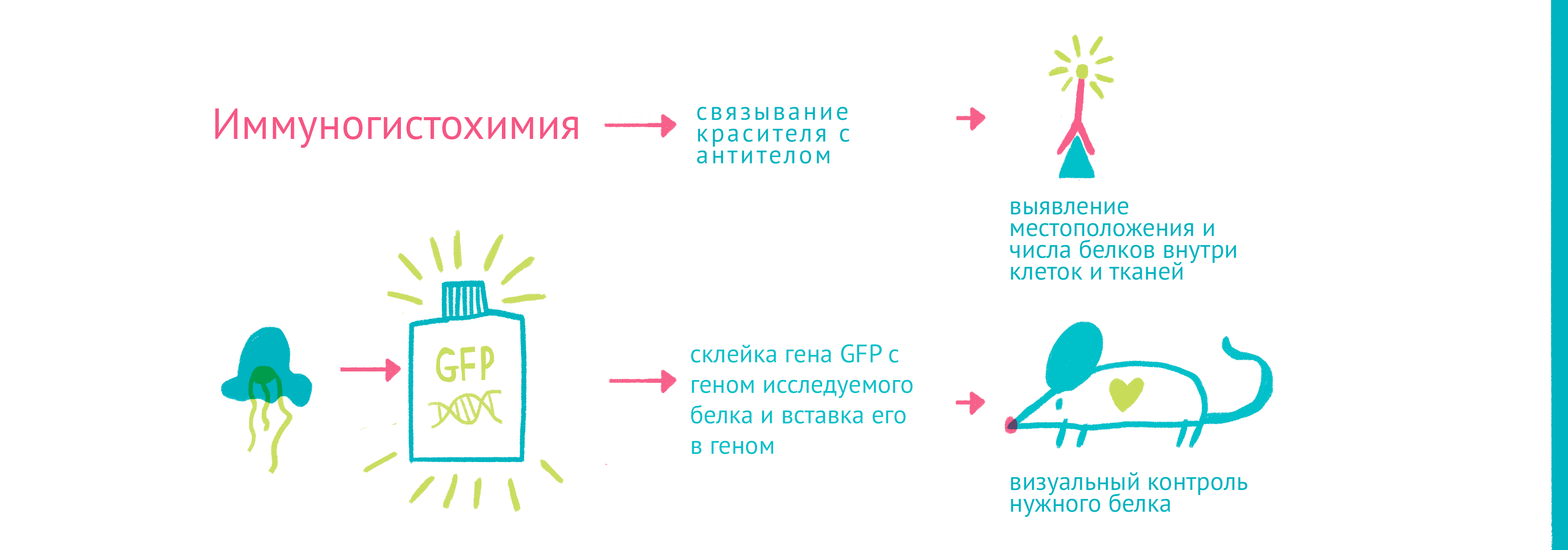 |
| «Да будет свет»: флуоресцентные белки помогают наблюдать процессы в живых клетках. С помощью генетической инженерии ген GFP совмещается с геном белка, за которым мы хотим «установить слежку», и получившийся химерный ген кодирует белок, помеченный с помощью GFP. С помощью этого подхода можно пометить клетки, экспрессирующие нужные нам гены, или наблюдать за биохимическими реакциями и взаимодействиями белков. Чтобы увидеть рисунок в полном размере, нажмите "Открыть изображение в новой вкладке" |
Помимо этого довольно быстро обнаружили белки всех цветов спектра, а их свойства усовершенствовали для лучшей флуоресценции и стабильности. За флуоресцентные и генетические технологии, связанные с GPF, в 2008 году вручена Нобелевская премия. Сегодня есть флуоресцентные белки, которые светятся в присутствии определенных молекул (кальция, АТФ, глюкозы, глутамата и т.п.), начинают флуоресцировать при связывании двух белков друг с другом, активации определенных клеточных процессов (например, клеточной гибели) или изменении активности транскрипционных факторов.
Флуоресцентная микроскопия позволяет получать красочные изображения, светящиеся собственным светом, и в то же время за счет использования светофильтров рассматривать свечение разных цветов отдельно. Так можно изучать распределение нескольких меток, например антител к разным белкам, каждое из которых окрашено своим флуоресцентным красителем. В основе метода лежит Стоксов сдвиг: при возбуждении электрона во флуоресцентном красителе (флуорофоре) источником света, испускаемый фотон обладает большей длиной волны за счет потери части колебательной энергии, что позволяет отфильтровать яркий свет, которым освещают образец для возбуждения, и наблюдать только свет от флуоресцентной метки.
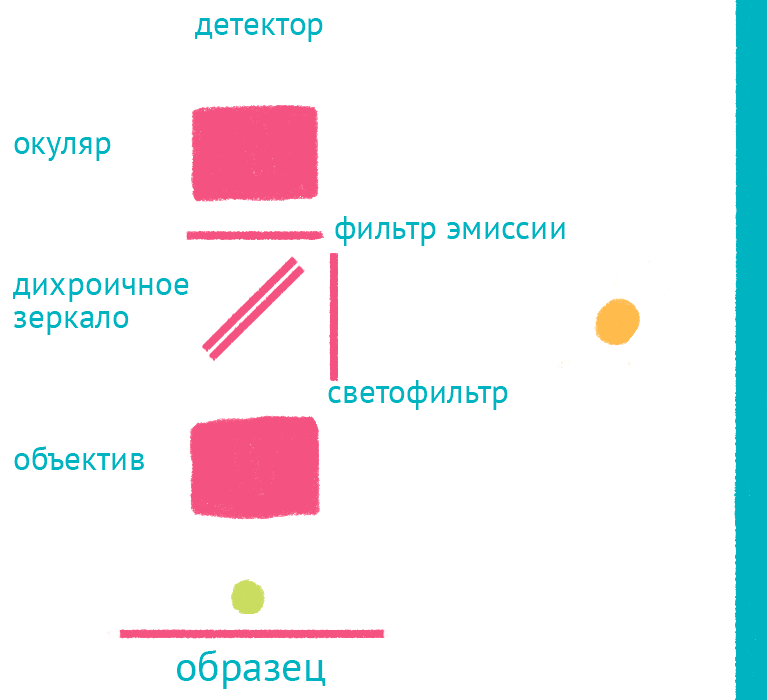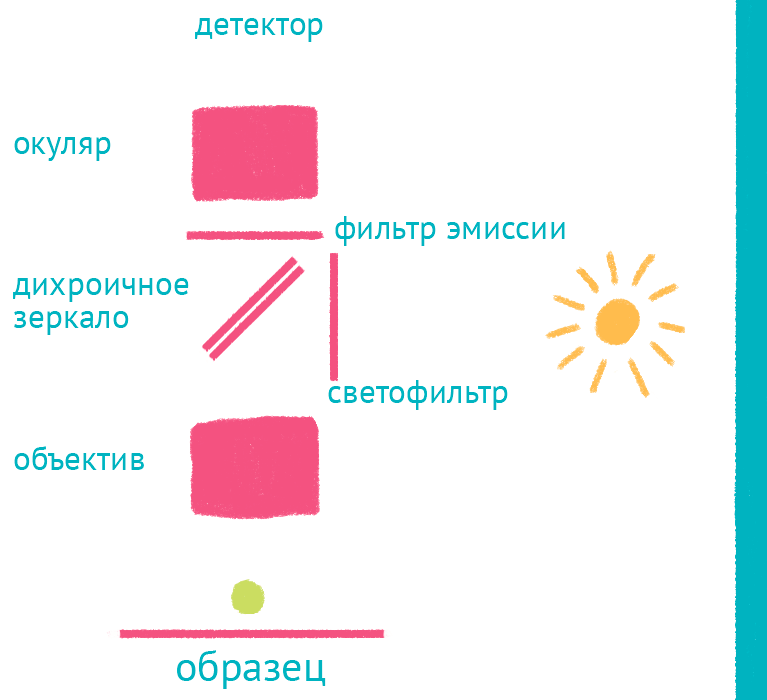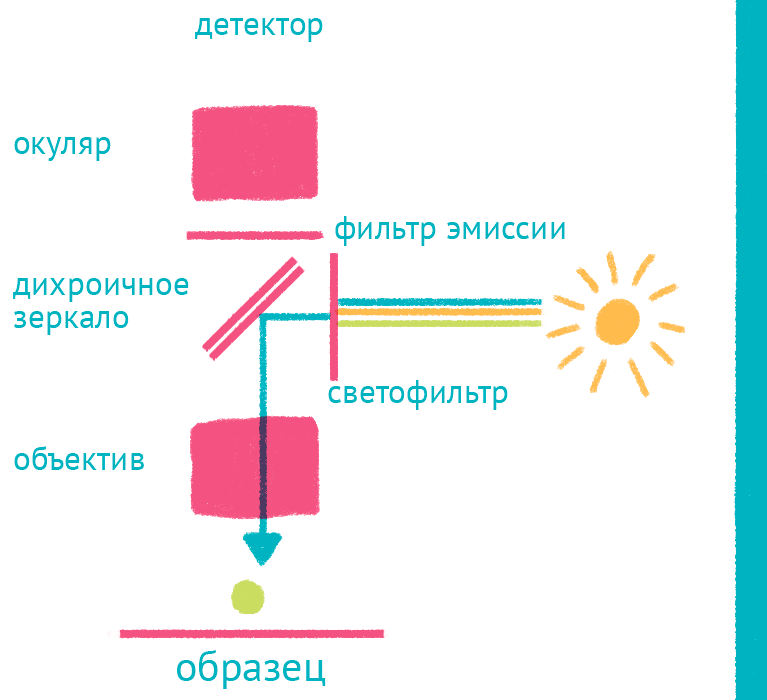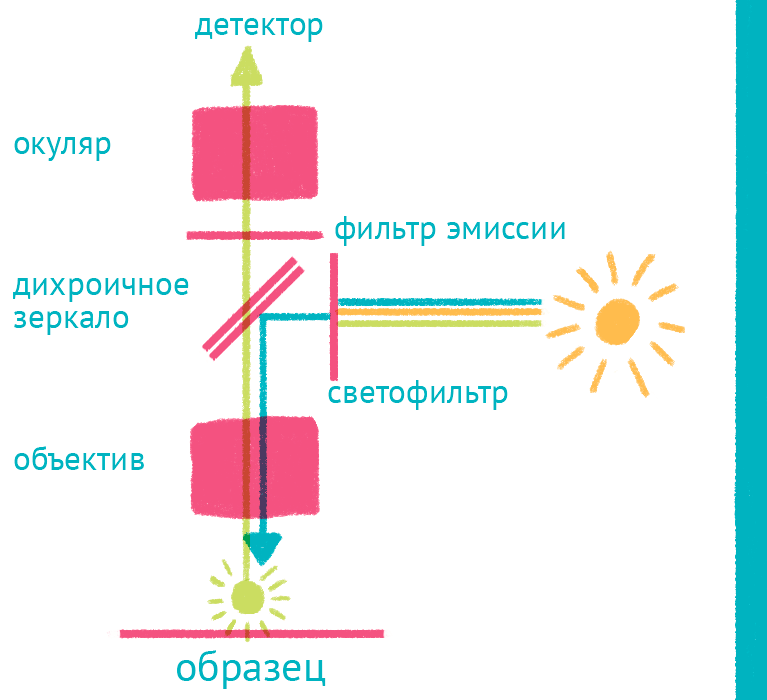 |
| Флуоресцентный микроскоп: лабиринт отражений. Дихроичное зеркало и объектив фокусируют возбуждающий свет на препарате и направляют флуоресцентный свет к окуляру по другому оптическому пути. |
Источник света во флуоресцентном микроскопе – яркая лампа (ртутная или галогеновая). Свет от лампы проходит через светофильтр, который оставляет оптимальные для возбуждения флуоресцентной метки длины волн. Прошедший через светофильтр свет отражается дихроичным зеркалом и фокусируется объективом на образце, возбуждая флуоресценцию метки. Такая схема микроскопа, в которой возбуждающий свет фокусируется не конденсором, а самим объективом, называется эпифлуоресцентной, и позволяет значительно уменьшить фоновую засветку от лампы. Флуоресцентный свет от препарата через объектив вновь попадает на дихроичное зеркало, которое уже прозрачно для смещенной длины волны света от флуоресцентной метки, и на второй светофильтр, который дополнительно отсекает фоновый свет от лампы. Микроскоп содержит несколько комплектов светофильтров и зеркал, которые можно быстро сменить в зависимости от метки, что позволяет снимать даже микроскопические фильмы с несколькими флуоресцентными метками одновременно.
Современные микроскопы позволяют изучать препарат всеми вышеописанными методами, быстро заменяя или совмещая компоненты оптического пути, например, фазового контраста и флуоресценции. Быстрое последовательное переключение между флуоресценцией и фазовым контрастом (например, за счет автоматического открытия диафрагмы) позволяет получить обоими методами фотографии одного и того же участка препарата, которые затем можно совместить для получения суммарного изображения. Такой микроскоп дает максимум информации на одном и том же препарате за небольшое время.
 Мой юный друг, тебе, конечно же, знакомы организмы, обладающие флуоресценцией. А теперь, внимание, традиционный блиц-вопрос. Во время Второй мировой войны японцы подсвечивали ими карты. Ответ и фото присылай в Telegram.
Мой юный друг, тебе, конечно же, знакомы организмы, обладающие флуоресценцией. А теперь, внимание, традиционный блиц-вопрос. Во время Второй мировой войны японцы подсвечивали ими карты. Ответ и фото присылай в Telegram.
Конфокальная микроскопия
Качество флуоресцентной микроскопии было ограничено из-за возбуждения флуоресценции вне оптического фокуса. Конфокальная микроскопия позволила рассматривать флуоресценцию только в фокусе объектива, и реконструировать трехмерные изображения из послойно снятых фокусных планов. Для этого используют точечный источник света, сканирующий образец, и точечную диафрагму, отсекающую свет вне оптического фокуса. Первую такую конструкцию запатентовал Марвин Мински в 1961 году. Однако первый работающий микроскоп сконструировал в Чехословакии Моймир Петран, который в 1967 году вместе с Дэвидом Эггером и Робертом Галамбосом впервые применил его для изучения биологических образцов. В 1980-х годах в качестве источника света начали применять лазер, и конфокальная микроскопия быстро стала альтернативой обычному флуоресцентному микроскопу.
.png) |
| Моймир Петран. Чехословацкий ученый с коллегами создал первый работающий конфокальный микроскоп. |
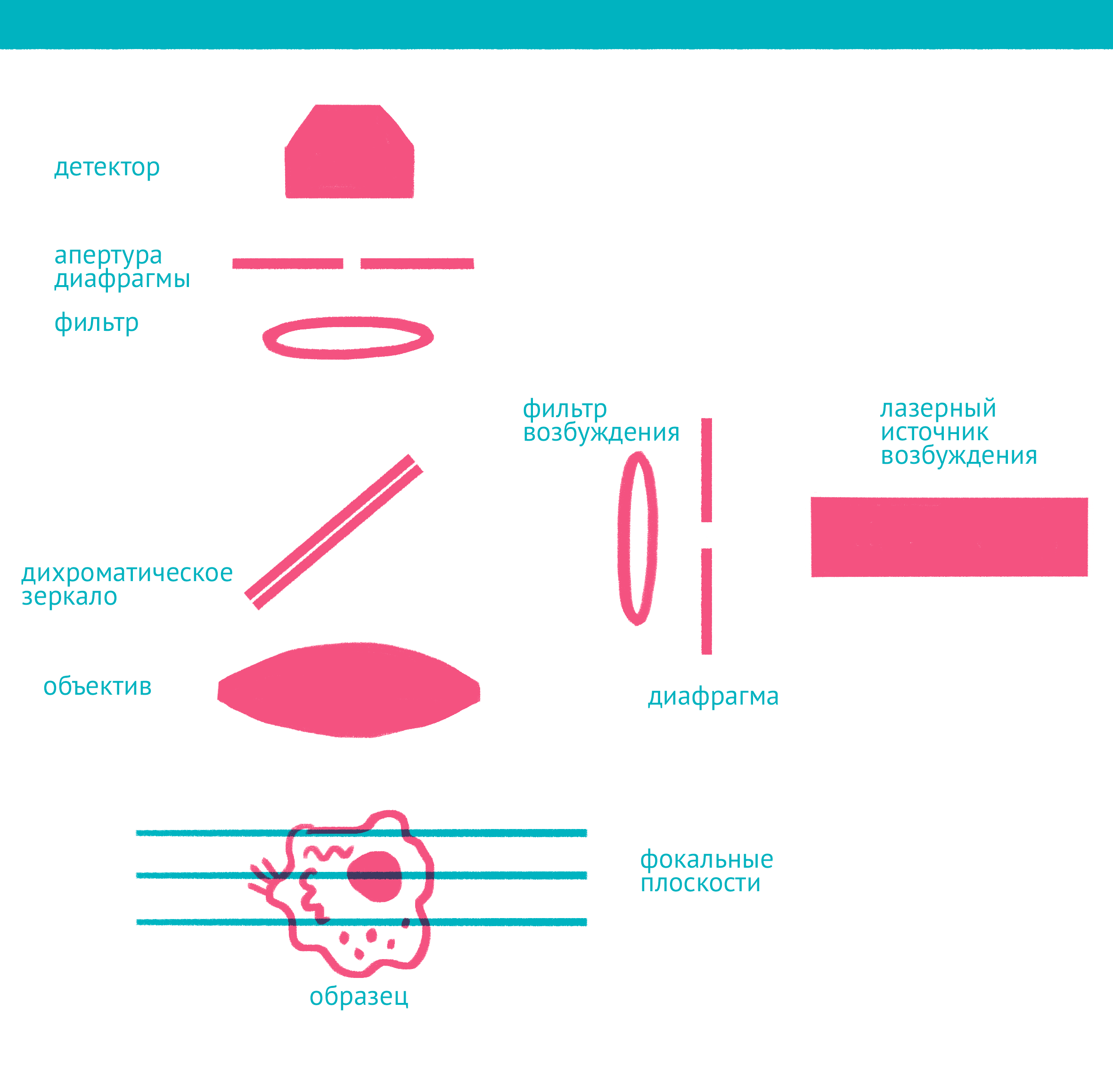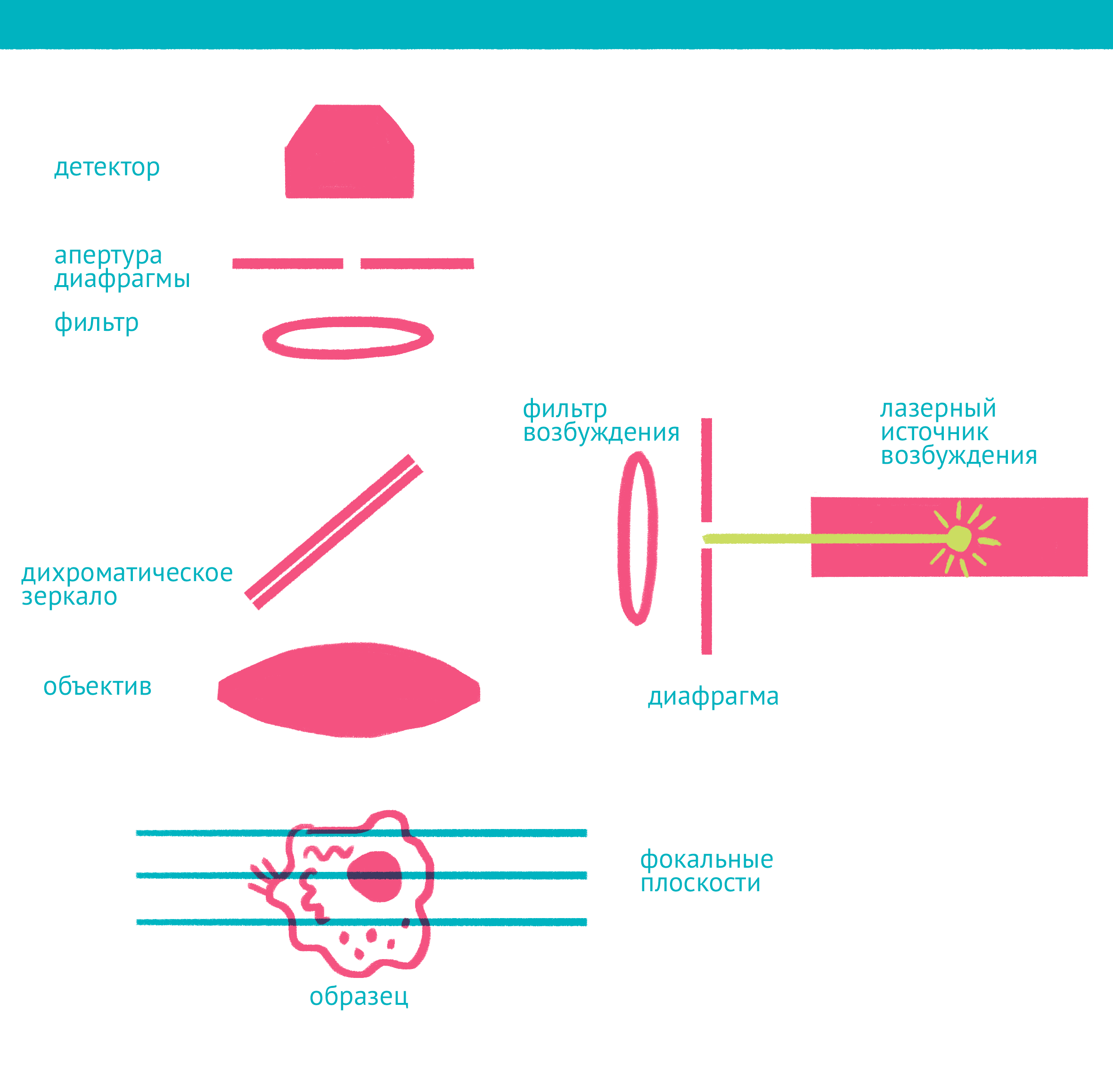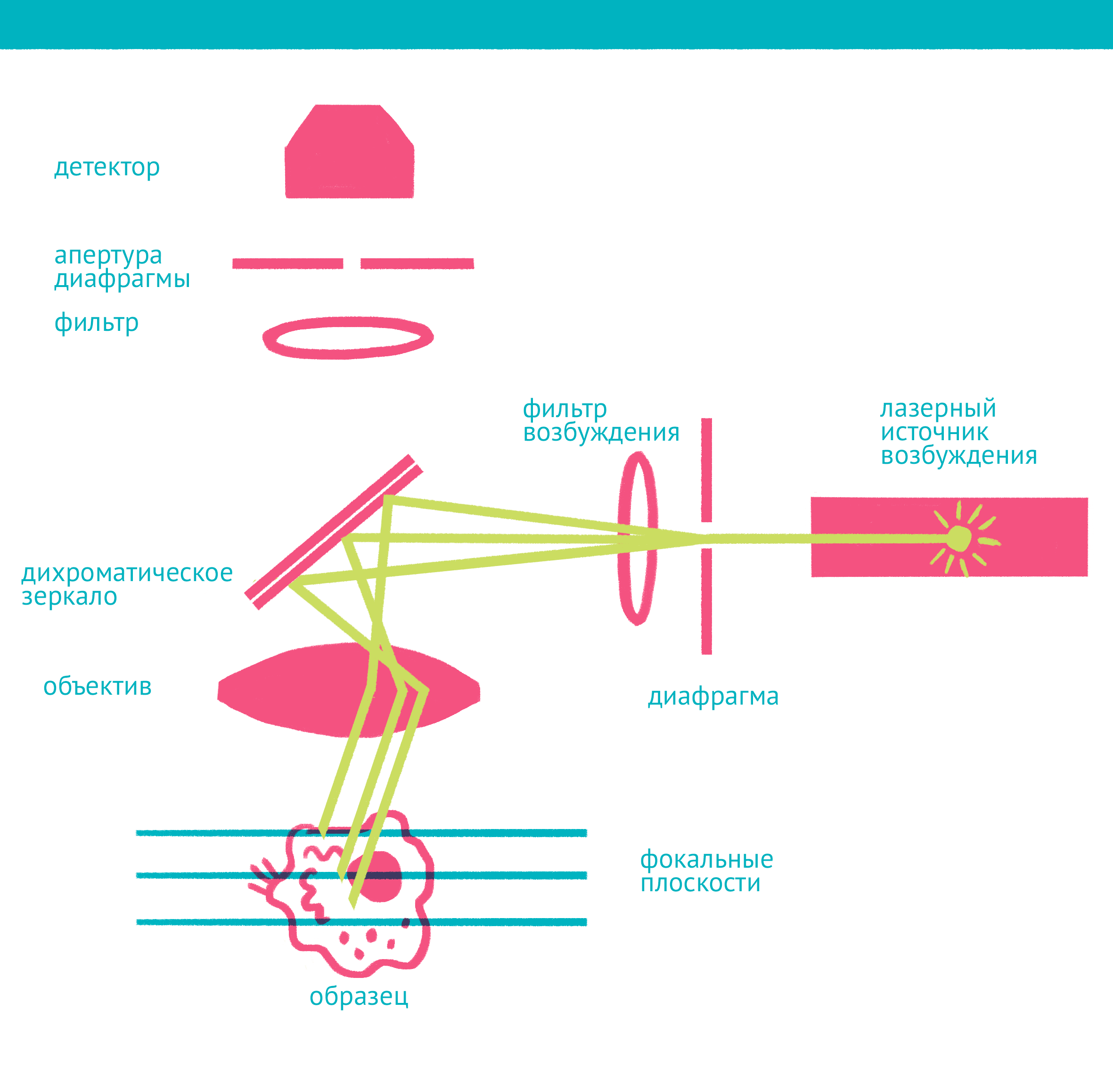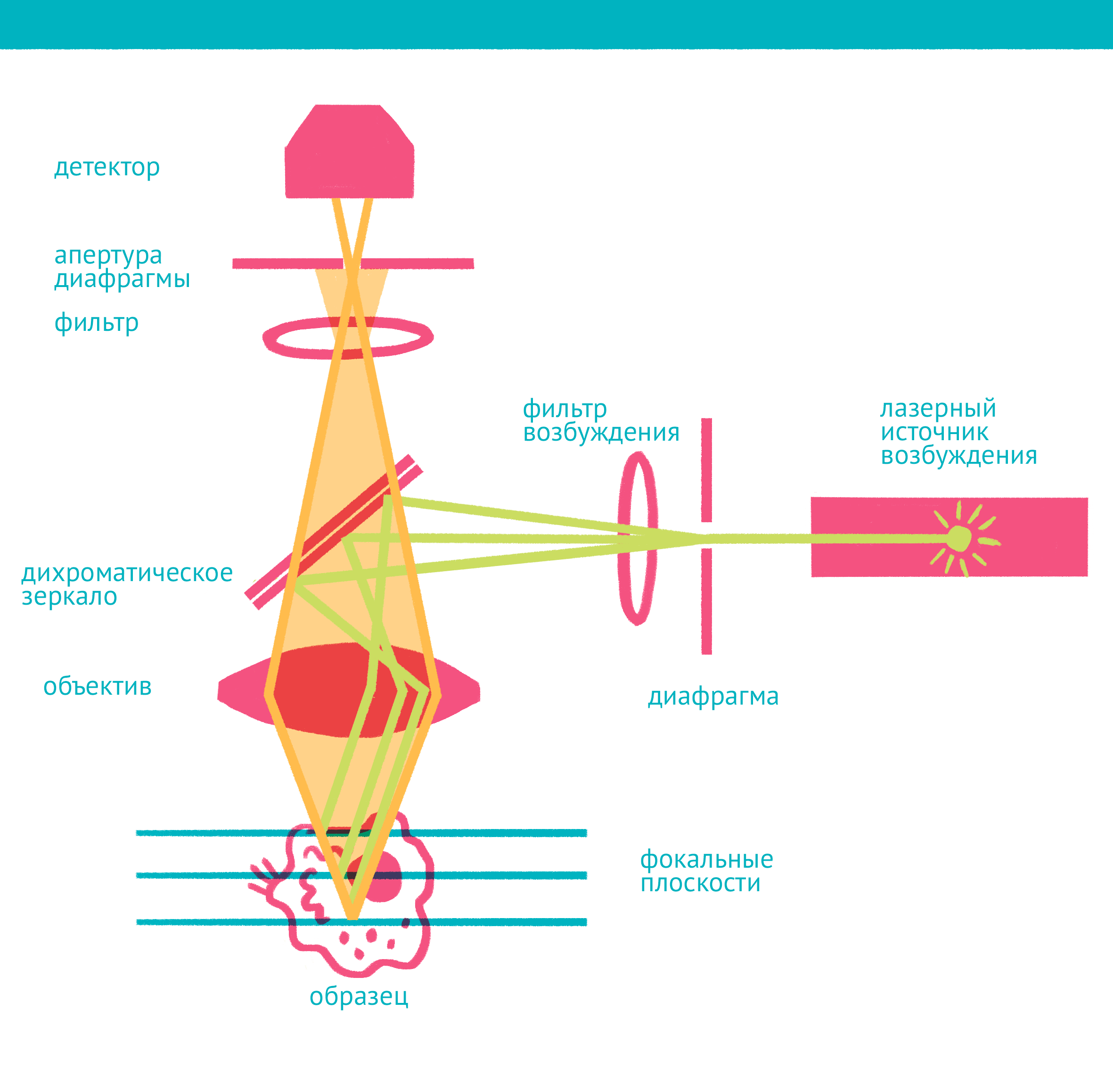 |
| Конфокальная микроскопия: через замочную скважину. В конфокальной микроскопии свечение возбуждается лазером, ограниченным точечной диафрагмой. Вторая диафрагма, помещенная после дихроичного зеркала и светофильтра эмиссии в плоскости фокуса объектива (конфокальной плоскости), отсекает свет, находящийся не в фокусе объектива. Передвижение луча лазера по препарату достигается двумя зеркалами, контролируемыми точными гальванометрическими двигателями. Переход между оптическими плоскостями (ось Z) осуществляется с помощью движения объектива вверх или вниз. Чтобы увидеть рисунок в полном размере, нажмите "Открыть изображение в новой вкладке". |
Лазерная сканирующая конфокальная микроскопия является модификацией флуоресцентной микроскопии, улучшающей качество изображения и позволяющей строить трехмерные реконструкции препарата, а также в некоторых модификациях манипулировать биологическими объектами с помощью лазера. В конфокальной микроскопии, в отличие от флуоресцентной, свечение возбуждается не во всём препарате, а точечно. Перемещение лазера сканирует препарат, подобно тому, как распечатывает изображение принтер.
Соответственно, по сравнению с флуоресцентной микроскопией, в конфокальном варианте появляется несколько новых компонентов (фото выше): прежде всего это две точечные диафрагмы, отсекающие свет, который находится вне фокуса объектива. Возбуждение света происходит с помощью лазера, сканирующего препарат, а регистрация – чувствительным фотоумножителем. Конфокальный микроскоп позволяет получать тонкие оптические срезы, и так как флуоресценция от препарата вне фокуса не попадает на детектор, то им можно снимать объемные объекты – например, стадии эмбрионального развития.
.png) | 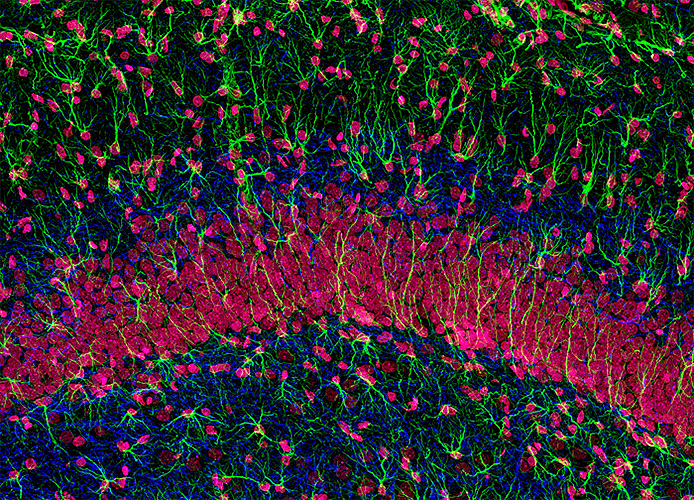 | 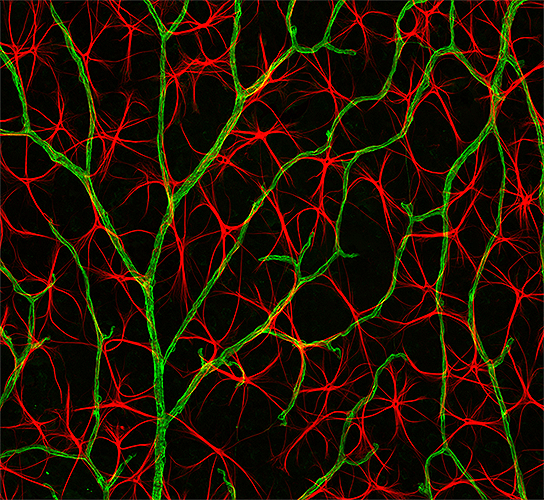 |
| Конфокальная микроскопия: не только срезы, но и сравнительно крупные объекты. Периферийные нервы в зародыше мыши. | Конфокальная микроскопия: не только срезы, но и сравнительно крупные объекты. Гиппокампальные нейроны на срезе мозга крысы. | Конфокальная микроскопия: не только срезы, но и сравнительно крупные объекты. Окраска мышиной сетчатки на маркер астроцитов (красный — GFAP) и кровеносные сосуды (зеленый — коллаген IV). |
Так как интенсивность лазера можно регулировать, а точечная диафрагма концентрирует свечение в одной точке, конфокальный микроскоп позволяет использовать лазер для точного воздействия на объект исследования. Например, лазером можно выжечь свечение флуоресцентного белка в части клетки и замерить скорость его восстановления в этой области, то есть скорость, с которой происходит диффузия белка. Этот метод называется FRAP (Fluorescence recovery after photobleaching). С помощью лазера можно повреждать клетку или только ее ядро, или активировать светочувствительные белки, запуская различные клеточные процессы.
Двухфотонная (мультифотонная) микроскопия является модификацией конфокальной микроскопии, позволяющей отказаться от точечных апертур. Возбуждение в таком микроскопе происходит за счет возбуждения флуорофора одновременным попаданием двух фотонов неоптимальной длины волны от мощного лазера. Вероятность такого события падает с квадратом расстояния, поэтому эффективное возбуждение происходит только в месте фокусировки лазера.
Электронная микроскопия
Дифракционный предел больше ста лет ограничивал оптическую микроскопию, пока не появились идеи, как его преодолеть. В 1930-х годах создали новую технику, позволяющую рассмотреть внутриклеточные структуры максимально близко: электронную микроскопию. Ее идея состоит в использовании электронов в качестве средства «освещения». Длина волны у электрона на 5 порядков (в 100 000 раз) меньше, чем у фотона, что дает разрешение до 50 пикометров! Электронная микроскопия позволяет рассматривать вирусы и структуру белковых комплексов.
В принципе, устройство электронного микроскопа очень похоже на микроскоп оптический. В качестве источника электронов (осветителя в обычном микроскопе) используется электронная пушка, в которой поток электронов от источника (например, вольфрамовой нити) фокусируется с помощью цилиндрического электрода (цилиндра Венельта). В качестве линз используют электромагнитные катушки, работающие как магнитные линзы. Для того чтобы электроны не задерживались молекулами воздуха, внутри микроскопа создают вакуум.
.png) |
| Принцип работы трансмиссионного электронного микроскопа. Электроны от пушки фокусируются магнитными линзами и, проходя через сверхтонкий образец, попадают на флуоресцентный экран. |
В трансмиссионной электронной микроскопии (фото выше) изучают очень тонкие срезы клеток: препараты вирусов и тому подобные неплотные образцы. Часть электронов рассеивается или поглощается образцом, в то время как прошедшие через образец электроны попадают на флуоресцентный экран, создавая «тень» от образца – где более плотные части образца будут более темными на изображении. Трансмиссионная электронная микроскопия требует предварительной фиксации и обезвоживания препарата, а также его очень тонкой нарезки, и часто для увеличения контрастности препарат необходимо окрасить соединениями тяжелых металлов. Все эти процедуры не дают возможности наблюдать живую клетку и часто искажают изображение препарата. К тому же подготовка препаратов крайне трудоемка по сравнению с оптической микроскопией.
Электронная микроскопия позволяет метить молекулы с помощью антител, используя металлические метки (например, коллоидное золото) вместо флуорофоров, однако количество меток, которое можно использовать, ограничено по сравнению с флуоресцентной микроскопией. Несмотря на то, что именно трансмиссионная электронная микроскопия позволила нам рассмотреть структуру органелл внутри клетки, ее ограничения и дороговизна не позволяют этому методу войти в широкий лабораторный обиход.
Используя пучок электронов, образец можно «сканировать» поточечно (фото ниже), как в конфокальной микроскопии. Такой метод называется сканирующей электронной микроскопией, и в ней обычно регистрируются вторичные электроны, испускаемые образцом при попадании электронного пучка, и электроны, отраженные образцом. Метод сканирующей электронной микроскопии обычно используют для изучения поверхности образца, хотя вариант сканирующей трансмиссионной электронной микроскопии позволяет изучать тонкие срезы.
.png) |
| Сканирующий электронный микроскоп позволяет изучать поверхность препарата за счет многих видов отраженного излучения. |
Именно сканирующая электронная микроскопия дает потрясающие объемные изображения клеток, бактерий, кристаллов, белковых матриксов и многих других объектов.
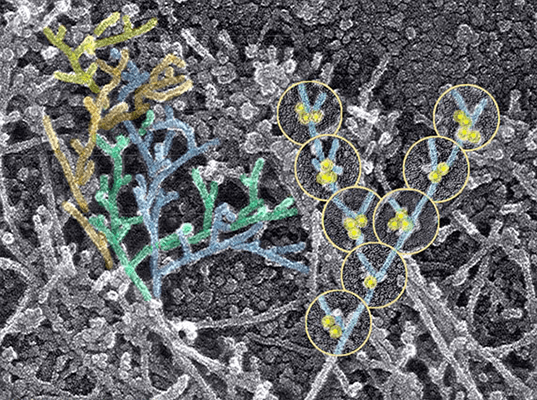 | 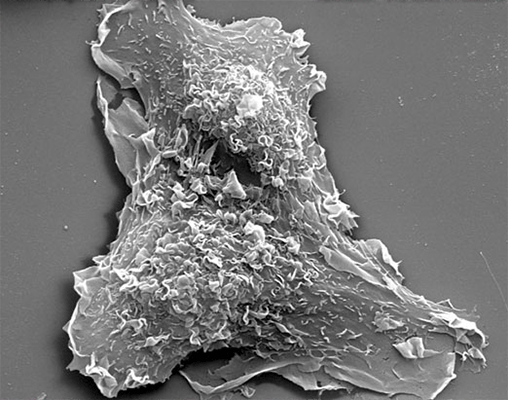 |
| Трансмисионная электронная микроскопия. Структура цитоскелета около ведущего края фибробласта. | Сканирующая электронная микроскопия. Макрофаги и эндотелиоциты. |
 | 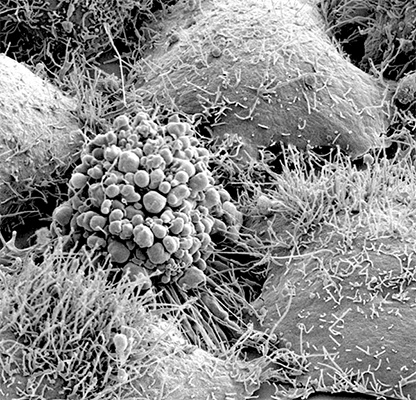 |
| Сканирующая электронная микроскопия. Фрагмент глаза дрозофилы. | Сканирующая электронная микроскопия. Апоптотическая клетка. |
Методы суперразрешения
Электронная микроскопия продвинула исследования далеко за предел разрешения оптической микроскопии, однако она не позволяет смотреть на живые объекты и использовать разноцветные метки или красители. Возможно ли преодолеть дифракционный предел в оптической микроскопии? Методы, преодолевающие предел Аббе, называются методами суперразрешения. Мы подробно остановимся на двух таких методах, за которые присудили Нобелевскую премию по химии 2014 года.
В 1990-х исследователи начали разрабатывать методы для преодоления дифракционного предела Аббэ. Центральную роль в разработке этих методов играл Штефан Хелль, который разработал STED-микроскопию. В методике STED возбуждение флуорофора происходит с помощью двух лазеров – один возбуждает флуоресценцию в точке фокуса, в то время как другой тушит ее вокруг этой точки за счет смещения флуоресценции в более красную область. За достижением Хелля последовало изобретение других суперразрешающих методов – PALM/STORM, GSDIM и других.
Штефан Хелль одним из первых понял, что возможно преодолеть дифракционный предел, используя свойства самих флуорофоров. Идея Хелля состояла в том, что не обязательно ограничивать дифракцию света, который стимулирует флуоресценцию, если можно «запретить» флуоресцировать молекулам вне самого центра фокуса. Для этого он придумал использовать принцип стимулирования испускания: в нем флуорофор в возбужденном состоянии переводится в невозбужденное состояние вторым лазером. За счет использования «более красной» длины волны испускаемый при стимулированном переходе фотон имеет большую длину волны (такую же, как и лазер) и не регистрируется детектором.
Как же можно увидеть изображение, если мы подавили флуоресценцию во всем образце? Дело в форме луча света второго лазера – проходя через специальную фазовую пластинку, он приобретает форму кольца, и интенсивности подавляющего лазера в узкой центральной точке не хватает для подавления флуоресценции. Таким образом, флуоресценция возбуждается только в узкой фокусной точке, которая по размерам гораздо меньше предела дифракции. STED-микроскопия позволяет получать изображения с разрешением меньше 20 нм в поперечном направлении, и около 40–50 нм в продольном направлении.
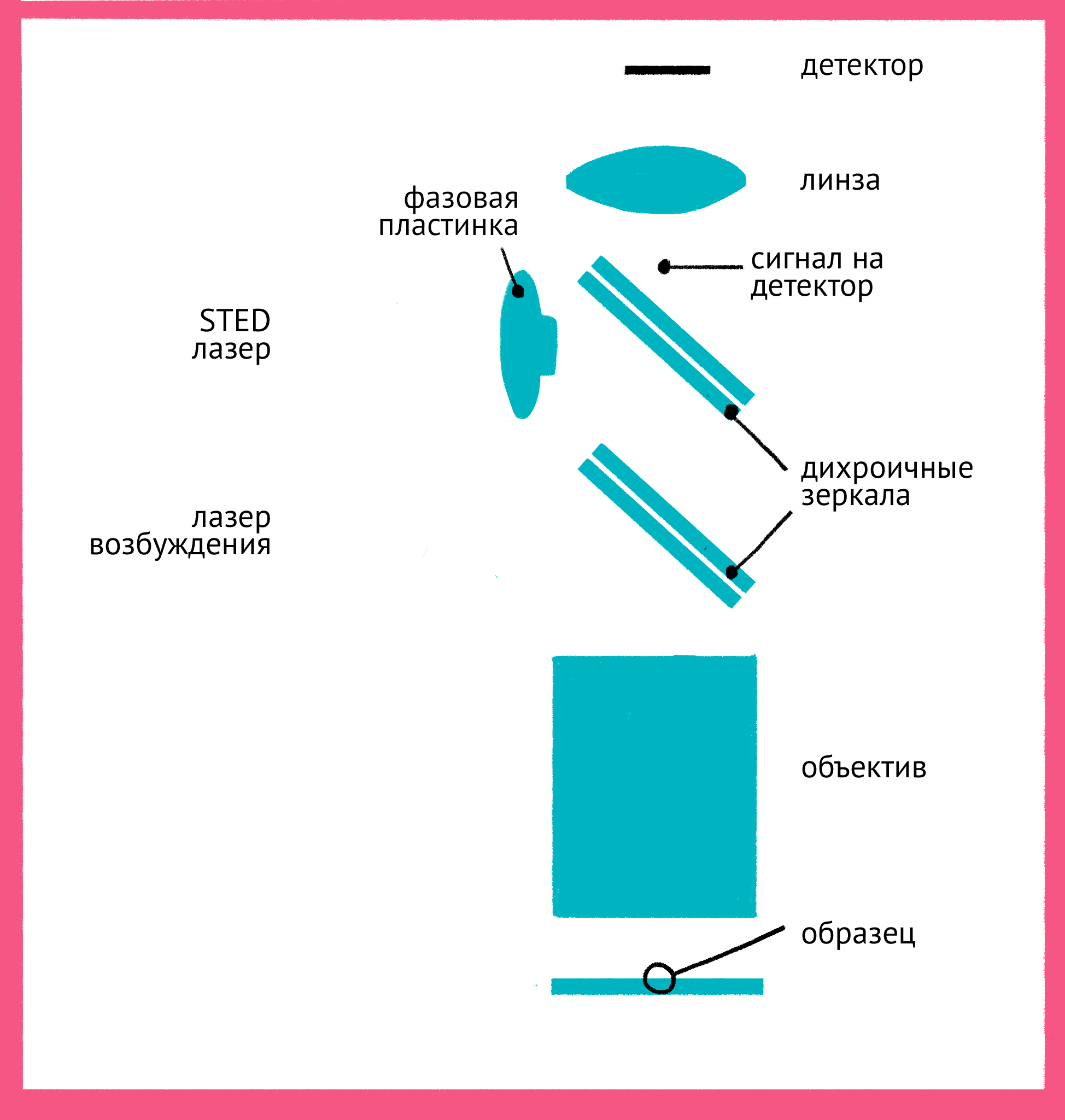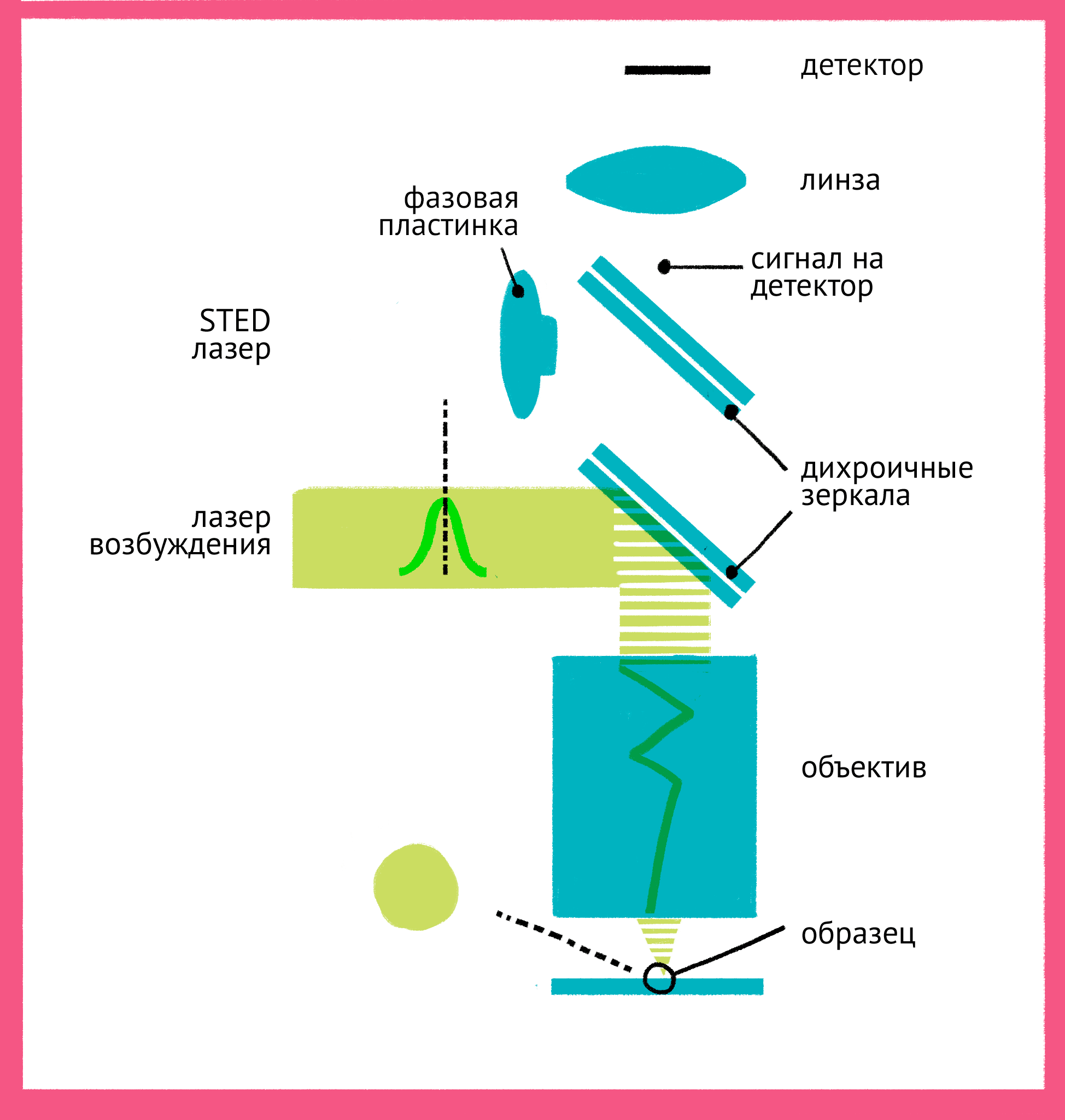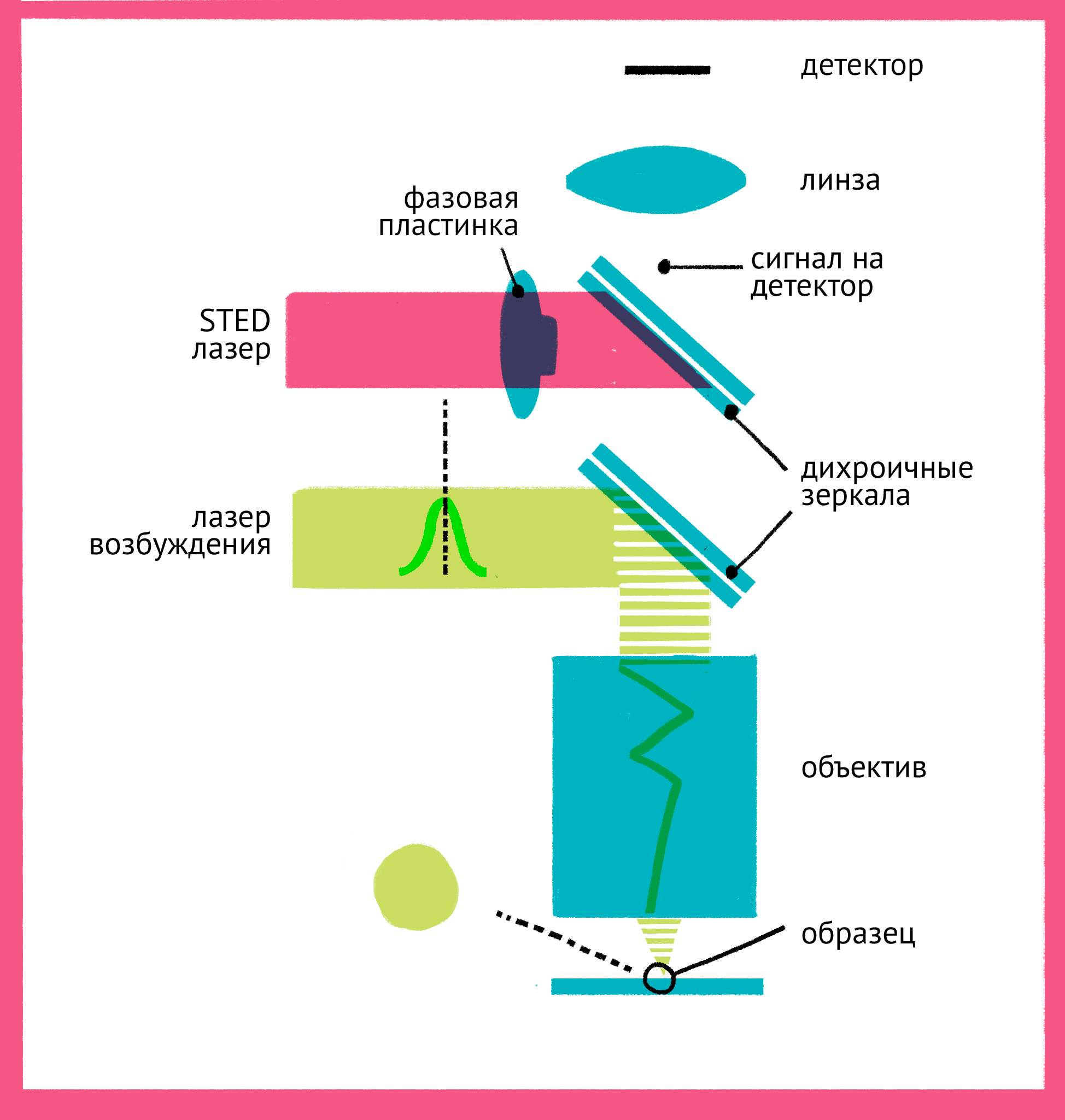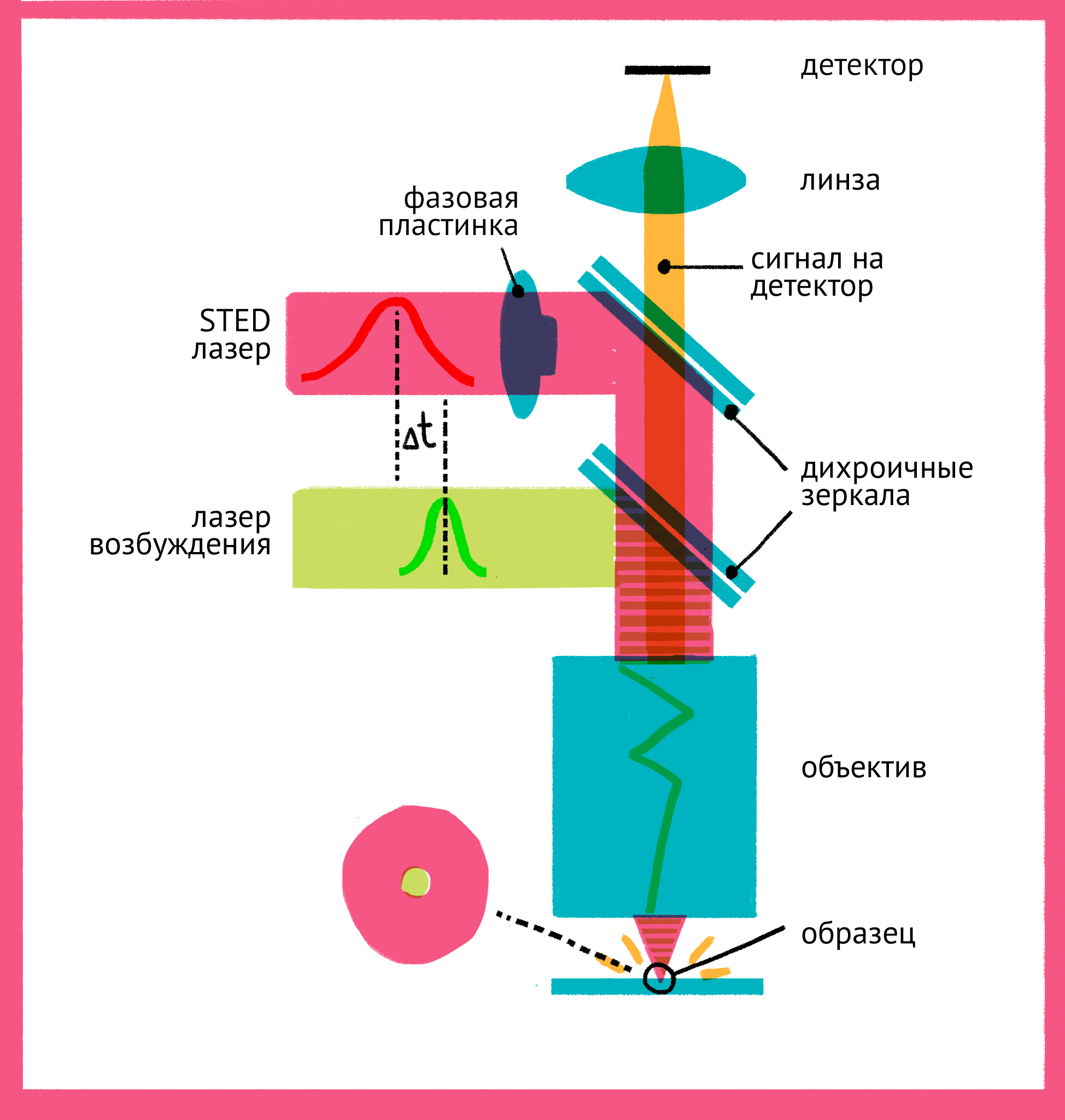 |
| Принцип микроскопии суперразрешения. Для STED-микроскопии необходимы два лазера: флуоресценция возбуждается первым зеленым лучом, а второй, красный, лазер подавляет флуоресценцию за счет стимуляции испускания. Из-за фазовой пластинки в середине пути второй лазер имеет форму кольца, поэтому в центре его мощности не хватает для подавления флуоресценции. Таким образом флуоресценция возбуждается только в центре – в узкой фокусной точке, куда попадает свет только от первого лазера и которая по размерам гораздо меньше предела дифракции. Чтобы увидеть рисунок в полном размере, нажмите "Открыть изображение в новой вкладке". |
Другим подходом стало ограничение флуоресценции флуорофоров по времени. В PALM/STORM/FPALM-микроскопии используют специальные флуорофоры (флуоресцентные белки или синтетические флуорофоры), которые могут переключаться между возбужденным и невозбужденным состоянием (см. видео). Низкочастотный возбуждающий лазер возбуждает лишь часть молекул, так чтобы статистически возбужденные молекулы были разделены расстоянием больше дифракционного предела. Высокочувствительная камера регистрирует флуоресценцию от этих молекул, позволяя точно определить их положение по испускаемым фотонам. Второй лазер подавляет флуоресценцию и возвращает молекулы обратно в невозбужденное состояние. После многократного повторения этого цикла (в каждом цикле случайно возбуждаются разные молекулы флуорофора), компьютер составляет цельную картину из изображений, снятых в отдельных циклах.
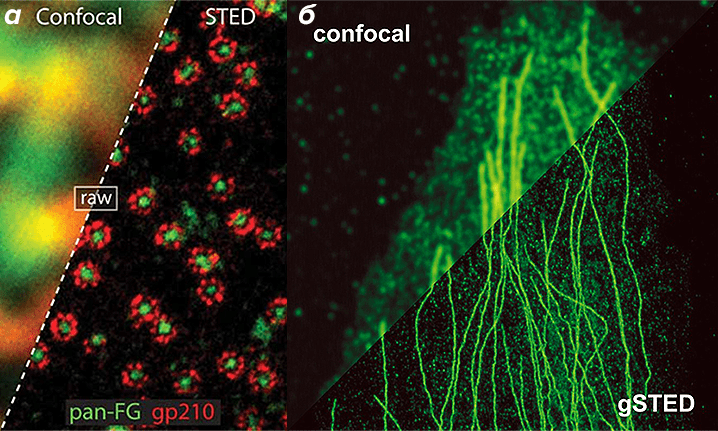 |
| Преимущества микроскопии суперразрешения. а – Ядерная пора («обычная» конфокальная микроскопия vs. STED). б – Цитоскелет («обычная» конфокальная микроскопия vs. STED). |
STED и PALM/STORM являются наиболее распространенными видами суперразрешающей микроскопии, однако существует множество методов на их основе или использующих сходные принципы: SIM, GSD, SSIM, dSTROM и другие – оптическая микроскопия продолжает развиваться, расширяя границы нашего познания о микромире.
Задание. Путь познаний сложен и тернист. Сегодня было много новых терминов, сложной информации, для подкрепления предлагаю приготовить клетку-пиццу, по аналогии с растительной или животной клеткой. Можно воспользоваться нашим рецептом (смотри видео) и пригласить на ланч всех, кто сможет присоединиться к вам в исследовании микромира!
Или приготовьте печенье, похожее на бактерий
 |
| Жевательная резинка, миндаль в сахаре, ванильное печенье, орехи в шоколаде, засахаренные вишни… Будьте внимательны! На многих из этих картинок – отнюдь не сладости, а нечто совершенно иное! Рассмотрите рисунки и найдите бактерии, маскирующиеся под конфеты. ОТВЕТ ты найдешь ниже на этой странице, под зеленой формой! |
ФОТО ВАШЕЙ ПИЦЦЫ ИЛИ ВАШЕГО ПЕЧЕНЬЯ ПРИСЫЛАЙТЕ СЮДА:
(Ответ. Бактерии представлены на тех иллюстрациях, что обведены голубой рамочкой. Это мельчайшие организмы с очень простым строением. Они живут в воздухе, воде, почве; их можно найти в организме других живых существ, на снегу и льду, в горячих термальных источниках. Они могут жить даже в сильно загрязненной среде, без воздуха и там, где не способен выжить ни один другой организм. Бактериальные клетки могут быть округлыми или продолговатыми. Ядерный материал в их клетках не отделён от цитоплазмы мембраной. Бактерии круглой формы часто собираются в группы и тогда выглядят как цепочка бус или виноградная гроздь. Некоторые бактерии вызывают опасные заболевания. Другие очень сильно помогают нам и даже могут защищать от некоторых своих опасных родственников)
Источники:
сайт www.thorlabs.com
сайт wellcomeimages.org
сайты www.photonics.com и www.picoquant.com
